| 4.3 无机熔体与玻璃(9)
4.3.7 玻璃结构参数
为了表示硅酸盐玻璃结构特征和便于比较玻璃的物理性质,引入4个基本结构参数:
X——每个多面体中非桥氧数的平均数Onb
Y ——每个多面体中桥氧数的平均数Ob
Z—— 每个多面体中形成剂离子的配位数,对于硅酸盐玻璃Z = 4,硼酸盐玻璃Z = 3
R—— 玻璃中全部氧离子与全部网络形成剂离子之比,O总/形成剂离子总数,亦即通常所说的玻璃氧硅比。
根据玻璃组成来计算。
这些参数之间存在两个简单的关系:
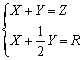 或 或 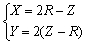 (4-19) (4-19)
只要给定玻璃组成,就可计算R,再用上式计算得到X、Y。Y又称结构参数,玻璃的很多性质取决于Y值,由Y值此即可判断玻璃特性:Y值大,网络结构紧密,强度大,膨胀系数小,电导率小,粘度大;反之,Y值小,网络结构疏松,强度小,膨胀系数大,电导率大,粘度小。用玻璃结构参数描述硅酸盐玻璃的网络连接特点以及玻璃特性对比是很方便的。
下面举例说明结构参数的计算。
石英玻璃:Z = 4,R = 2,所以X = 0,Y = 4
Na2O·SiO2:R = 3/1 = 3,所以 ,
14mol% Na2O·8mol%CaO·78mol%SiO2玻璃:Z = 4
故 X=2×2.28-4=0.56,Y=Z-X=4-2=2
但是,并不是所有玻璃都能简单地计算出这四个参数,当玻璃中含有Al3+、Pb2+等网络中间离子时,就很难准确计算R值。在含R2O、RO的硅酸盐玻璃中,当Al2O3/(R2O+RO)<1时,认为Al3+进入网络四面体中,形成[AlO4],也就是认为Al2O3起到“补网作用”,此时Al3+作为网络形成离子计算。当Al2O3/(R2O+RO)>1时,则简单地把全部Al3+作为网络中间离子计算。实际上,有可能部分Al3+能起到“补网作用”,但定量处理比较困难,如此简化处理后计算出来的Y值比真正的Y值要小。当玻璃组成按质量百分数表示时,要将其换算为摩尔百分数。
当计算出X、Y值后,可再计算玻璃中桥氧百分数和非桥氧百分数:
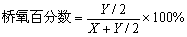 , , 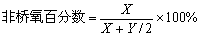 (4-20) (4-20)
4.3.8 硼酸盐玻璃及硼反常现象
硼酸盐玻璃具有某些优异的性能而使它成为不可替代的一种玻璃材料,引起人们的广泛重视。例如,硼酐是唯一能用于制造有效吸收慢中子的氧化物玻璃,硼酸盐玻璃对X射线透过率高,电绝缘性能比硅酸盐玻璃优越。
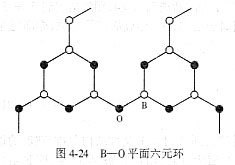 硼酸盐玻璃中B-O之间形成sp2三角形杂化轨道,它们之间形成3个s键还有p键成分。所以[BO3]是其基本结构单元,[BO3]之间以顶点连接,B和O交替排列成平面六角环,这些环通过B-O-B链连成网络,见图4-24。由于B2O3玻璃的层状结构特性,层内B-O键很强,而层与层之间由较弱的分子间连接,所以B2O3玻璃的一些性能比SiO2玻璃差,例如B2O3玻璃软化温度低(约450°C)、化学稳定差(易在空气中潮解)、热膨胀系数高,因而纯B2O3玻璃使用价值小,只有与R2O、RO等氧化物组合后才能制成稳定的有实用价值的硼酸盐玻璃。实验证明,当数量不多的R2O、RO同B2O3一起熔融时,所形成的玻璃特性如图4-25所示,图中各种性能的变化规律与硅酸盐玻璃相比,出现了反常的情 硼酸盐玻璃中B-O之间形成sp2三角形杂化轨道,它们之间形成3个s键还有p键成分。所以[BO3]是其基本结构单元,[BO3]之间以顶点连接,B和O交替排列成平面六角环,这些环通过B-O-B链连成网络,见图4-24。由于B2O3玻璃的层状结构特性,层内B-O键很强,而层与层之间由较弱的分子间连接,所以B2O3玻璃的一些性能比SiO2玻璃差,例如B2O3玻璃软化温度低(约450°C)、化学稳定差(易在空气中潮解)、热膨胀系数高,因而纯B2O3玻璃使用价值小,只有与R2O、RO等氧化物组合后才能制成稳定的有实用价值的硼酸盐玻璃。实验证明,当数量不多的R2O、RO同B2O3一起熔融时,所形成的玻璃特性如图4-25所示,图中各种性能的变化规律与硅酸盐玻璃相比,出现了反常的情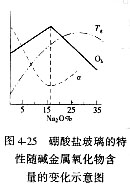 况,因而称为硼反常现象。这是由于B2O3玻璃的基本结构单元为[BO3]平面三角体,加入少量R2O、RO后,使一部分[BO3]转变为[BO4]-架状结构,从而加强了网络结构,使玻璃的各种性能变好。随着R2O、RO加入量的增多,所生成的[BO4]-也增多并相互靠近,当超过一定加入量后,[BO4]-的静电斥力增大,结构发生逆转变化,性能也随之发生逆转变化,即架状结构遭破坏,重新回到[BO3]平面三角体结构,反映在性质变化曲线上是随着R2O、RO加入量而出现极值。 况,因而称为硼反常现象。这是由于B2O3玻璃的基本结构单元为[BO3]平面三角体,加入少量R2O、RO后,使一部分[BO3]转变为[BO4]-架状结构,从而加强了网络结构,使玻璃的各种性能变好。随着R2O、RO加入量的增多,所生成的[BO4]-也增多并相互靠近,当超过一定加入量后,[BO4]-的静电斥力增大,结构发生逆转变化,性能也随之发生逆转变化,即架状结构遭破坏,重新回到[BO3]平面三角体结构,反映在性质变化曲线上是随着R2O、RO加入量而出现极值。
B2O3玻璃的转变温度约为300°C,比SiO2玻璃低得多(1200°C),利用这一特点,硼酸盐玻璃广泛用作焊接玻璃、易熔玻璃以及涂层物质的防潮和抗氧化。硼对中子射线的灵敏度高,硼酸盐玻璃作为原子反应堆的窗口对材料起到了屏蔽中子射线的作用。
|

