| 3.5 无机非金属材料组成与晶体结构(3)
6. a-ZnS(纤锌矿)型结构
a-ZnS晶体属六方晶系,简单六方格子,P63mc空间群,ao=0.382nm,co=0.625nm,z = 2,CN± = 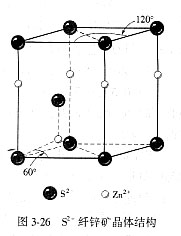 4。在纤锌矿结构中(见图3-26),S2-按六方紧密堆积排列,根据正、负离子半径比可知Zn2+填充在四面体空隙中,根据可产生的空隙数与正离子数目比关系可知Zn2+只占据了1/2四面体空隙。晶胞中有4套等同点。每套代表质点的坐标是:S2-—0 0 0,2/3 1/3 1/2;Zn2+—0 0 u,2/3 1/3 (u-1/2)。其中u=0.875,可以根据四面体的配位结构从几何关系将其推导得到。 4。在纤锌矿结构中(见图3-26),S2-按六方紧密堆积排列,根据正、负离子半径比可知Zn2+填充在四面体空隙中,根据可产生的空隙数与正离子数目比关系可知Zn2+只占据了1/2四面体空隙。晶胞中有4套等同点。每套代表质点的坐标是:S2-—0 0 0,2/3 1/3 1/2;Zn2+—0 0 u,2/3 1/3 (u-1/2)。其中u=0.875,可以根据四面体的配位结构从几何关系将其推导得到。
与纤锌矿结构同类的晶体有BeO、ZnO、AlN等。
上面讨论了AX型二元化合物若干晶体结构类型,其中CsCl和NaCl是比较典型的离子晶体,离子配位关系符合Pauling规则。在ZnS晶体结构中,已不完全是离子键,而是由离子键向共价键过渡,这是因为Zn2+有18个外层电子,同时S2-的极化力a较高,所以晶体中存在着较明显的离子极化,改变了正、负离子之间的距离和键性,但尚未引起晶体结构类型的根本改变。对于ZnO晶体结构,根据r+/r-的值,Zn2+的配位数应该为6,本应属于NaCl型结构。但实际上,由于离子极化的结果,r+/r-值下降,配位数和键性都发生了变化,Zn2+的配位数为4,结构类型与理论预期的结构不同。这就充分体现了极化性能对晶体结构的影响。
7. CaF2(萤石)型结构
CaF2晶体属立方晶系,面心立方格子,Fm3m空间群,z = 4。
Pauling第一规则,r+/r- = 0.75 > 0.732,CN+ = 8,所以Ca2+配位多面体形状是立方体,F-位于顶角,Ca于体心。配位多面体是以共棱关系连接。
Pauling第二规则,Ca2+静电键强度S=2/8=1/4,故每个F-必须与4个Ca2+形成静电键,即F-应该位于Ca2+的四面体中。
为了便于把CaF2晶体的结构与对称特点显露出来,通常将Ca2+看成“立方紧密堆积”,F-占据全部四面体空隙。由于F-半径大,Ca2+不可能相互接触。CaF2晶体中有3套等同点。图3-27是按这种思路画出了CaF2晶胞结构图、正离子配位关系以及配位多面体连接方式。CaF2晶体中部分质点坐标表示如下:Ca2+—0 0 0,1/2 1/2 1;F-—1/4 1/4 3/4,3/4 3/4 1/4。
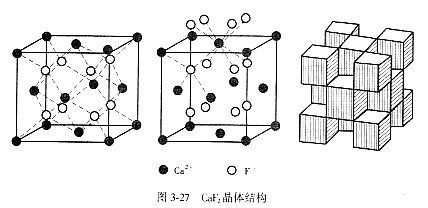
CaF2晶体结构中,由于以Ca2+形成的“紧密堆积”中,全部八面体空隙都没有被填充,也就是说8个F-之间形成了一个“空洞”,结构比较开放,有利于形成负离子填隙,也为负离子扩散提供了条件。在萤石型结构中,往往存在负离子扩散机制,并且是主要机制。立方ZrO2属萤石型结构,常被用作测氧传感器探头、氧泵、固体氧化物燃料电池中的电解质材料等,被称作固体快离子导体,就是因为ZrO2晶体中具有氧离子扩散传导的机制,在900~1000°C间O2-电导率可达0.1 S/cm。
除了ZrO2之外,属于萤石型结构的晶体还有UO2、ThO2、CeO2、BaF2、PbF2、SnF2等。
ZrO2有3种晶型:单斜相、四方相和立方相。单斜ZrO2的结构类似于萤石型结构,存在扭曲和变形,此时r+/r-=0.6087,Zr4+以8配位结构方式存在是不稳定的,经实验证明,其配位数为7。
当在萤石型结构中正、负离子位置全部互换,就得到反萤石型结构,它并没有改变结构形式,只是正、负离子位置对调,如Li2O、Na2O、K2O等。其中Li+、Na+、K+占有萤石结构中的F-位置,而O2-占据Ca2+的位置。
CaF2熔点较低,在玻璃工业中可用作助熔剂,也有用作晶核剂。萤石中质点之间的键力较NaCl强,反应在其性质上,就是萤石的硬度稍高,为莫氏4级,熔点达1410°C,在水中溶解度小。在(111)面上存在着相互毗邻的同号负离子层,因静电斥力导致晶体平行于(111)方向发生解理,故萤石常呈八面体解理。
|

