
 |
第8章 相平衡与相图 |
| 8.5 相图热力学基本原理(4) 8.5.3 自由能-组成曲线相互关系的确定 设有一二元可形成固相溶液和液相溶液系统。其组成A、B,熔点分别为TfA和TfB。当系统温度T1高于组分B熔点而低于组成A熔点(TfB<T1<TfA),此时液相溶液的获得应考虑如下过程: T=T1 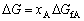  故液相溶液形成自由能 为: 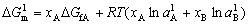 (8-77) (8-77)式中, 为T1温度下,组成A熔化自由能。可按下述方法近似计算: 当T=TfA时,ΔGfA=ΔHfA-TfAΔSfA=0 在其它温度下熔化时,ΔGfA=ΔHfA-TfAΔSfA≠0 设熔化热ΔHfA与熔化熵ΔSfA在TfA温度附近范围内不随温度变化,故由上面两式得: 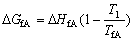 (8-78) (8-78)将式(8-78)代入式(8-77),得: 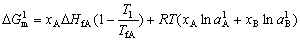 (8-79) (8-79)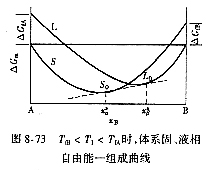 同理,对于固相溶液,应考虑如下过程: 同理,对于固相溶液,应考虑如下过程:T=T1 .gif) 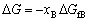  故得固相溶液自由能 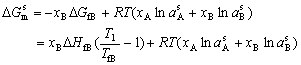 (8-80) (8-80)若假设混合为理想状态,并将ΔGmL和ΔGms绘于同一自由能-组成坐标系中可得图8-73,可以看到:固相线S与液相线L并不重合,而是两曲线相交并存在一公切线,切点为S0和L0。显然,根据能量最低原理与两相平衡化学位相等原则,对应于这一自由能-组成曲线关系的相平衡关系为:当组成点xA<xαs时,体系存在单一固溶体相;当xA>xβs时,体系存在单一液相;而当xαs<x<xβL时,组成为xβL的固溶体和组成为 的液相共存。 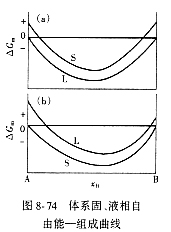 基于与上述同样的考虑,不难推出当系统温度同时高于和低于两组分A、B熔点时,体系液相溶液和固相溶液的自由能-组成关系式。 基于与上述同样的考虑,不难推出当系统温度同时高于和低于两组分A、B熔点时,体系液相溶液和固相溶液的自由能-组成关系式。当T>TfA、TfB时: 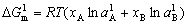 (8-81) (8-81)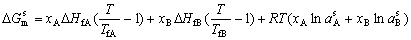 (8-82) 当T<TfA、TfB时: 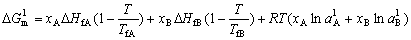 (8-83) 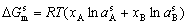 (8-84) (8-84)自由能-组成曲线的以上两种关系绘于图8-74中,当T>TfA、TfB时,液相线在整个组成区域内均处于固相线以下,故体系可形成一稳定连续的液相。当T<TfA、TfB时,固相线处于液相线之下,故可形成一稳定的连续固溶体。 |
版权所有 民众工作室.制作 |