| 6.2 固体的表面(4)
6.2.3 表面行为
(1)表面吸附与偏析
吸附是指气相中的原子或分子附着在固体表面,而偏析则是指固溶体中的溶质原子富集在表面层。两种现象的热力学规律是相似的,均会引起材料实际表面的一系列物理、化学性能发生变化。
①吸附等温方程
吸附的平衡吸附量是由吸附剂和吸附物本身的性质所决定,外部条件,如温度、压力也有显著的影响。根据热力学第一、第二定律,引入表面能γS,表面相内能的变量可表示为:
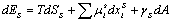 (6-13) (6-13)
式中:μi和xi分别表示第i种物质的化学势和摩尔分数,A为表面积。体系处于平衡态时,任意小的变化引起表面性质的变化可由Es方程求出:
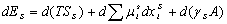 (6-14) (6-14)
将上两式相减得:
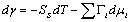 (6-15) (6-15)
式中:SS为单位表面的熵;Γi为单位表面吸附的第i种物质的量。当温度不变时,就得到吉布斯吸附等温方程:
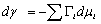 或 或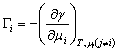 (6-16) (6-16)
上式也可以表示某组元表面偏析量的基本关系。在一定温度下,吸附情况下的化学势可以通过控制气压来决定,而偏析情况下则可以通过控制体相中溶质的成分来决定。如将表面平衡的蒸气看成理想气体,则:
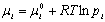 (6-17) (6-17)
式中:Pi是i组元的分压; 是在1个大气压下纯蒸气i的化学势,于是得出:
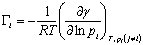 (6-18) (6-18)
②吸附与表面改性
表面改性是指通过各种表面处理改变固体表面的结构和性质,例如在复合材料制备中,无机填料经过表面改性,可使其原来的亲水性改为疏水性,这样就提高该物质对有机基质的润湿性和结合强度,从而改善复合材料的界面性能。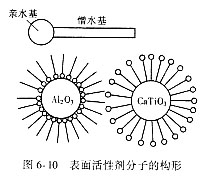
能够降低体系表面(或界面)张力的物质称为表面活性剂。表面改性中最常用的是各种有机表面活性剂。表面活性剂必须指明对象,而不是对任何表面都适用,如钠皂是水的表面活性剂,硫、碳是液态铁的表面活性剂。水的表面活性剂分子一般由两部分组成(图6-10),一端是具有亲水性的极性基,如-OH、-COOH、
-SO3Na等;另一端具有疏水性的非极性基,如碳氢基团、烷基、丙烯基等。适当地选择表面活性剂的这两个原子基团的比例就可以控制其油溶性和水溶性的程度。
|

