| 3.3 晶体场理论和配位场理论(4)
3.3.7 配位场理论的基本概念
在晶体场理论中,它所假设的前提是:在中心阳离子与配位体之间的化学键是离子键,彼此间不存在电子轨道的重叠,亦即没有共价键的形成;同时,配位体被作为点电荷来处理。但这种假定的前提条件在共价性强的化合物,例如硫化物、含硫盐及其类似化合物中,显然是不能适用的。
为了克服上述缺陷,在晶体场理论的基础上发展了配位场理论。后者除了考虑到由配位体所引起的纯粹静电效应以外,还考虑了共价键的效应。它引用了分子轨道理论来考虑中心过渡金属原子与配位体原子之间的轨道重叠对于配合物能级的影响,但基本上依然采用晶体场理论的计算方式。
分子轨道理论强调分子是一个整体,其中的所有电子都属于整个分子。分子中电子的运动状态则由分子轨道来描述。分子轨道不仅与金属原子的电子轨道相关,而且还与配位体原子的电子轨道相关,由它们按一定的规则共同组合而成,组合的具体方式则取决于这些电子轨道的空间分布及其对称性。
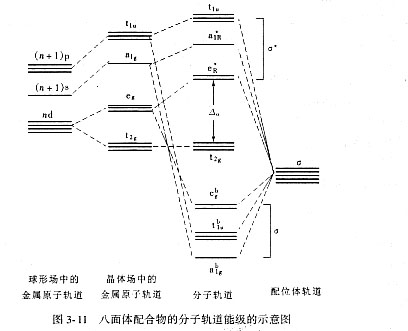
图3-11是由一个过渡金属原子与六个配位体所构成的八面体配合物的分子轨道能级图。对于第一过渡系列的金属原子而言,它参与组成分子轨道的有五个3d轨道、一个4s轨道及三个4p轨道。其中沿坐标轴方向伸展的dz2与dx2-y2(eg组)以及s、px、py、pz六个轨道,与处在八面体配位位置上的六个配位体之s轨道发生重叠。它们共同组成六个成键s分子轨道和六个反键s*分子轨道。成键分子轨道代表了发生重叠的两个原子轨道的相加,它的能量比后两者单独存在时的能量都要低,因而电子充填成键分子轨道可使分子趋于稳定。反键分子轨道则代表了原子轨道间的相减,其能量相应地比原来原子轨道都要高,因而不如组成它的原子轨道稳定。至于金属原子中t2g组的dxy、dxz和dyz轨道,因它们都是沿着坐标轴的对角线方向伸展,不可能参与组成s分子轨道,因而它们有可能保持非键状态,或者与配位体的p轨道共同组成p分子轨道。图3-11是不形成p键时的情况。
(本节完)
|

