| 3.1 结合键(4)
3.色散力
非极性分子偶极矩为0,通常是指其核外电子云呈球形对称分布而不显示永久的偶极矩,这是从宏观统计的角度来看的。但是由于正负电荷都在运动,就电子绕核运动过程中的某一瞬间,电子在空间的各个位置上的分布并非严格相同,这样就呈现出瞬间的正负电荷中心不重合,存在瞬间偶极矩,瞬间偶极子会对邻近非极性分子产生诱导作用而出现诱导偶极矩,瞬间偶极矩之间以及与诱导偶极矩之间发生静电作用力,称为色散力,其作用能为
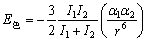 (3-9) (3-9)
式中,I1、I2分别为2个相互作用分子的电离能;a1、a2分别是它们的极化率。
对于不同物质,上述三种作用力并非均等,依其分子特性而定。对于非极性分子,静电作用力和诱导作用力很小,主要表现为色散力,静电力和诱导力只存在于极性分子中。这些作用力不仅存在于不同分子间,而且也存在于同一分子内的不同原子或基团之间。范德华键是上述3种力的合力,它与分子之间的距离的七次方成反比,说明分子间引力的作用范围很小,一般为0.3~0.5nm。范德华键通常表现为吸引力作用,因为当两个分子过分靠近而引起排斥力约等于B/r13,这种斥力随距离增大而迅速降低,降低速率比吸引力大106倍。
3.1.5 氢键
氢原子是所有原子中最小的一种,原子核带一个正电荷,核外有一个1s电子。当氢原子与电负性较高的原子X(如O、S、F、Cl等)以共价键结合成分子时,HX之间是极性共价键。这是因为氢原子核外的1s电子很容易受到X原子的强烈吸引,而使氢原子显部分正电性。在这种情况下,如果氢原子又受到另一个分子中电负性较大的原子Y吸引而形成以H原子为中心可表示为X—H××××××Y的氢键。氢键的键长指X和Y之间的距离。
氢键是分子间力的另一种表现,它与范德华键不同之处在于,氢键具有方向性和饱和性。氢键的饱和性表现在X—H只与一个Y原子结合,而X—H的偶极矩与Y相互作用时,只有当X—H××××××Y在同一直线上时才有最强的作用力,所以氢键有方向性。
氢键的强弱与X、Y的电负性差值的大小有关,电负性差值越大,氢键越强。另外,还与Y的半径大小有关系,半径愈小,则氢键愈强。大部分氢键是在分子间形成,称为分子间氢键,还有一部分氢键是同一分子内的不同部分之间形成的,叫做分子内氢键。
氢键虽然较弱,但它的形成对物质的物理性能影响不可低估,对结构相似的同系物,若分子间存在氢键,其结合力比色散力强,会使熔点、沸点显著升高;若分子内生成氢键,熔点、沸点常会降低。
水作为一种应用广泛的极性溶剂,主要是水分子之间可为生成氢键提供H原子,又有孤对电子接受其它分子来的H原子。因此,对于溶质分子来说,凡能为生成氢键提供与接受H原子的,均和水相似,可通过氢键和水结合,在水中溶解度较大。一些没有极性的碳氢化合物不能与水生成氢键,在水中溶解度很小。水的表面张力很大,主要生成分子间氢键。另外,分子间生成氢键会使粘度增大,如甘油、磷酸、硫酸等分子都是粘度很大的液体。这主要是这些化合物的一个分子能和几个其他分子形成几个氢键所致。当晶体中含有氢键时,则氢键也是影响晶体物理性能的因素之一。
(本节完)
|

