| 3.1 结合键(1)
3.1.1 离子键
离子键主要存在于离子晶体化合物中,本质上可以归结为静电吸引作用。离子键常发生在活泼的金属元素(如ⅠA、ⅡA和ⅢA主族金属元素和低价态的过渡金属元素)和活泼的非金属元素(如ⅥA、ⅦA主族元素和N元素等)之间。NaCl是典型的离子键化合物,它是由Na原子失去一个价电子,而Cl原子得到一个电子形成具有“稳定电子结构”的正、负离子,两个异号离子相互吸引形成NaCl晶体。
离子键的强弱程度通常用点阵能的大小表示,点阵能的含义是0 K时1 mol离子化合物的正、负离子,由相互远离的气态结合成离子晶体时所释放出的能量。点阵能负值越大,表示离子键越强,晶体越稳定。可以根据离子晶体中离子的电荷、离子的空间排列等结构数据来计算点阵能。离子间存在静电库仑力,异号相吸,同号相斥。按照库仑定律,一对球形离子Mz+和Xz-,距离为r,则其库仑作用力为
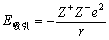 (3-1) (3-1)
当两离子逐渐互相靠近,在近距离接触时,电子云就会产生排斥作用,其排斥能为
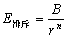 (3-2) (3-2)
式中,B是波尔排斥常数,其数值与离子的构型有关。当离子的电子构型相当于惰性气体He、Ne、Ar、Kr、Xe的电子构型时,B值分别可取5、7、9、10、12。如果正、负离子分别属于不同的电子构型,则B值可取正、负两种离子的平均值。例如,NaCl的值可取Ne和Ar的平均值,即(7+9) / 2 = 8。
一对正、负离子的总势能与离子间距的关系是
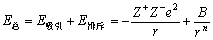 (3-3) (3-3)
当两离子处于平衡距离,即 时,体系的能量最低,并有
.gif) (3-4) (3-4)
由式(3-4)求得B表达式,代入式(3-3),可得一对正、负离子处于平衡位置时的总势能,即
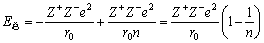 (3-5) (3-5)
然而在晶体中,正、负离子按照一定的规律排列,每个离子都与周围许多正、负离子存在相互作用,当然其作用力随着距离加大而迅速降低,总作用力为这些力的加和。考虑到晶体结构因素以及求总作用力加和非常困难,对MX型离子晶体处在点阵能最低值时,点阵能可用通式表示为
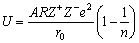 (3-6) (3-6)
式中,U为点阵能,A称为马德隆(Madelung)常数,它是与离子的空间排列形式有关的常数;R为阿伏加德罗(Avogadro)常数。
点阵能的大小与离子晶体的物理性质有密切的关系,一般认为,点阵能愈高,晶体的硬度愈高,熔点愈高,热膨胀系数愈小。在低温下,绝缘不传热;形成熔体时导电。可见光的能量不足以使离子的外层电子激发,因此,纯的离子晶体对紫外-可见光是无色透明的。
离子键主要是来源于过剩电荷,但在一定条件下会通过电场相互作用产生极化,离子极化经常会造成键能加强、键长缩短等现象。极化现象还能产生离子键向共价键过渡,使化合物中存在混合键型。由于键型变化,对离子化合物的物理性质产生重大影响。
离子键化合物中较重要的是碱金属的卤化物和氧化物,碱土金属的氧化物、硫化物、硒化物和碲化物等,它们属于AB型离子化合物(A为正离子,B为负离子)。此外还有CaF2型和金红石(TiO2)型两种代表性结构(AB2型);BiF3型、ScF3型和UCl3型(AB3型);刚玉型、立方C型、立方B型和三方A型等代表性结构型式(A2B3型)。还有数量众多的多元化合物含有离子键,当然也含有共价键甚至范德华键和氢键。
|

