| 3.1 结合键(2)
3.1.2 共价键
共价键与离子键不同,是另一种重要的化学键。本质上讲,当原子相互靠近时,原子轨道发生作用,组成新的分子轨道,引起原子间电子分布情况发生改变,使两原子间的电子聚集的程度变大,电子云密度增加,电子云同时受到两个原子核吸引,体系的能量降低,形成稳定的化学键,称为共价键。
按分子中原子的个数来说,共价键可分为双原子共价键和多原子共价键。双原子共价键是2个原子共用若干成对电子而形成,通常有单键、双键和叁键,但也有共用1个或3个电子的共价键。多原子共价键是多个原子共用若干个电子而形成的共价键。共价键按原子轨道作用方向的不同可分为s键、p键和d键。
为了阐明共价键,不同学者提出了一些共价键理论,如价键理论、分子轨道理论和杂化轨道理论。价键理论的基本内容是:分子由原子组成,假定原子在未化合前含有未成对的电子,且如果这些未成对电子的自旋相反,则两个原子间的两个自旋相反的电子可互相偶合,构成电子对。每个偶合形成一个共价键,因此,价键理论也称电子配对理论。它包括以下要点:
(1)如果原子A和原子B各有1个未成对的电子,它们自旋方向相反,则构成一个共价单键。如果A和B各有2个或3个未成对电子,则可配对构成共价双键或叁键。
(2)如果A有2个未成对的电子,B只有1个,那么A就能与两个B化合成AB2分子。
(3)原子在形成分子时,电子云重叠越多,键能越大,形成的共价键越稳固。因此,共价键形成时,将尽可能利用电子云密度最大的方向,也就是说共价键具有方向性。
(4)在共价键中,一个电子与另一个电子配对后,不再与第三个电子配对。所以,共价键还具有饱和性。
分子轨道理论从另一个角度来讨论共价键。该理论认为,当两个原子核位于它们的平衡位置时,所有电子将处于由这两个原子的原子轨道新组成的分子轨道中,分子轨道在许多方面类似于原子轨道,电子排布服从包利原理、能量最低原理和洪特规则。分子轨道分为成键轨道、反键轨道和非键轨道。按能级高低排列,成键轨道最低,反键轨道最高,非键轨道基本保持原子轨道的能级。由于电子首先填入能级最低的成键轨道,体系整体能量降低,使分子稳定。虽然反键轨道能级较高,但并不都是处于排斥状态,有时也可与其他轨道相互重叠形成化学键,也使体系能量降低。反键轨道是分子轨道的重要部分,它的参与可以解释许多共价键问题。反键轨道还是了解分子激发态性质的关键。
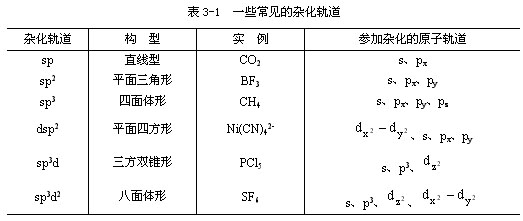
多原子分子中以杂化轨道形成共价键的现象十分普遍。杂化轨道理论可以很好地解释许多共价键结合中的特殊取向问题。所谓杂化轨道,是指当原子中多种原子轨道参与成键时,各种轨道可以互相“混合”组成对称性和方向不同于原来的原子轨道的新轨道。如CH4分子具有四面体结构,似乎很难理解,因为C原子的基态电子排列是1s22s22p2,只有2个2p未成对电子,按理只能形成CH2分子,但在大量稳定的有机碳化合物中,C原子是以4价存在,有理由推测存在这种可能性,即2s电子激发到2p轨道上,形成4个未成对电子,与4个H原子形成4个共价单键。事实上,它是由1个s轨道与3个p轨道重新“混杂”成4个新的在能量上和空间分布上完全等同的sp3杂化轨道。由此可见,原子轨道杂化后,轨道数目不变,轨道在空间分布方向和分布情况发生改变,在角度上较单纯的s轨道或p轨道在某一方向上更集中,可使它们在形成共价键时有更多的电子重叠,从而使整个分子的能量降低。一些常见的杂化轨道及其性质见表3-1。
在上述共价键理论中,价键理论虽然比较简单直观,但它毕竟是早期的理论,只能对共价键的形成作定性的解释,分子轨道理论和杂化轨道理论则可以给共价键作出更好的解释。由于共价键属于较强结合键,由共价键结合的晶体通常具有键能较大、熔点高、强度和硬度都较高和不导电等特点。
|

