| 3.2 晶体化学基本原理(3)
3.2.3 电负性
在金属晶体中,质点之间主要表现为纯金属键。对于高分子材料,则分子之间主要表现为分子键。在离子晶体中,除了金属键外,其他3种键都可能存在,而且由于存在着离子极化现象,使得离子键向共价键过渡。Pauling指出用元素的电负性差值ΔX=XA-XB来计算化合物中离子键的成分。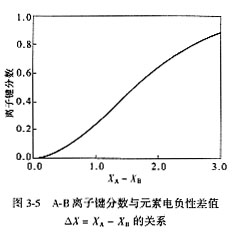
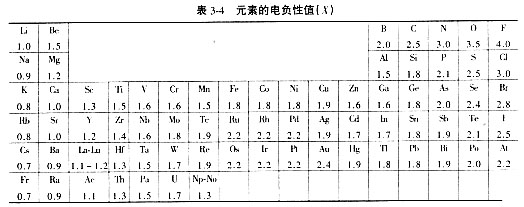
元素的电负性是这样规定的:当原子失去一个电子时所需要消耗的能量(即电离能),用I表示;当获得一个电子时所释放的能量(即电子亲合能),用Y表示。习惯上以0.18(I+Y)称为元素的电负性,用以比较各种元素吸引电子的能力。0.18这个系数是为了以Li元素的电负性为1而引入的。表3-4和图3-5列出了元素的电负性值以及电负性差值与离子键分数的关系。如NaCl,ΔX=3.0-0.9=2.1,以离子键为主。SiC,ΔX=2.5-1.8=0.7,以共价键为主。对于SiO2,ΔX=3.5-1.8=1.7,Si-O键既有离子性又有共价性。因此可以看出,两个元素电负性的差值越大,结合时离子键的成分越高;反之,则共价键的成分占主导。离子晶体,特别是硅酸盐晶体结构中,纯粹的离子键或者纯粹的共价键是很少见的,普遍的情况是存在着键的过渡形式。键性对晶体结构的影响前面已有述及。必须指出,以电负性差值判断离子键的分数仅有定性的参考价值。
3.2.4 结晶化学定律
哥希米德(Goldschmidt)在研究晶体结构时,综合考虑了影响晶体结构的因素,提出了哥希米德定律,即:晶体的结构取决于其组成质点的数量关系、大小关系和极化性能,常称为结晶化学定律。它定性地概括了影响晶体结构的3个主要因素。对于离子晶体,则:
(1) 物质的化学式类型不同,常会得到不同的晶体结构。如很多AX型物质具有NaCl型结构,A2X3型物质为刚玉型结构。由相同的阴、阳离子构成的TiO2和Ti2O3,由于数量关系不同,前者为金红石型结构,而后者为刚玉型结构。
(2) 晶体中质点大小不同,反映了离子半径比值( )不同,因而配位数和晶体结构也不同。 )不同,因而配位数和晶体结构也不同。
(3) 晶体中组成质点的极化性能不同,反映了各离子的极化率不同,则晶体结构也不相同。
总之,晶体结构与离子的数量、离子半径比和离子的极化率有关,但何者起决定作用,依具体情况而定,不能一概而论。
|

