| 5.7 固溶体生成热力学(3)
如果2UAB=UAA + UBB,则(5-102)式中第三项为零,即生成固溶体时内能没有变化。混合熵增加,则体系的自由能就下降,固溶体是稳定的。这是一种理想状态,这种固溶体必然是连续固溶体。图5-44(a)列出了U0、-TS、G与组成(即组分浓度)的关系曲线。
如果2UAB<<UAA+UBB,则(5-102)式中第三项为负值,加以混合熵为正值,系统的自由能显著降低,固溶体是稳定的。实际上这时A、B之间趋于生成化合物AmBn。
如果2UAB>>UAA+UBB,则(5-102)式中U0显著增大。即使混合熵增加,但系统自由能仍将增大。因此,形成固溶体是不稳定的,而分为A、B两相更稳定(图5-44(c)中P-S区间)。
如果2UAB处于一个中间状态,即略小于或略大于UAA+UBB,但如果混合熵的增加超过内能的变化(当2UAB>UAA+UBB时),则体系的自由能仍将下降,固溶体将是稳定的。如图5-44(c)中A-P、S-B区域。
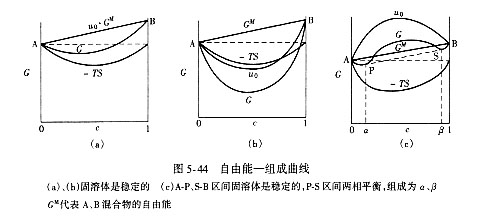
根据上面的讨论,可以从自由能—组成图中看出:若在整个组成范围内,自由能曲线呈U形,即曲线的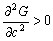 ,则固溶体是连续稳定的;如果在整个组成范围内,自由能曲线呈倒U形,即 ,则固溶体是连续稳定的;如果在整个组成范围内,自由能曲线呈倒U形,即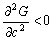 ,表示固溶体是不稳定的,而分成两相自由能降低,系统更稳定。在二元固溶体系中,若组成与自由能曲线犹如图5-43(c)形式,由于两相平衡应具有相同的化学势 ,表示固溶体是不稳定的,而分成两相自由能降低,系统更稳定。在二元固溶体系中,若组成与自由能曲线犹如图5-43(c)形式,由于两相平衡应具有相同的化学势 ,故在自由能—组成曲线中应具有公切线(图5-44(c)中P-S线),切点在组成坐标上的对应点,即为两个平衡相的组成,见图5-44(c)中a及b。 ,故在自由能—组成曲线中应具有公切线(图5-44(c)中P-S线),切点在组成坐标上的对应点,即为两个平衡相的组成,见图5-44(c)中a及b。
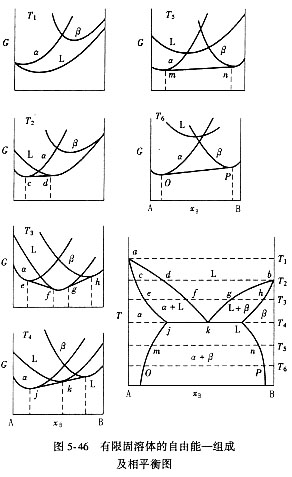
至此,可以容易地理解二元连续固溶体和有限固溶体的自由能-组成曲线。图5-45表示了从T1→T6不同温度时连续固溶体的自由能-组成曲线。在T2→T5温度下,固溶体a和液相L平衡,它的自由能曲线有公切线,相应的平衡组成为ca、cL。在Tl温度下,液相是稳定的,而T6温度时,固溶体是稳定的。图5-46是有限固溶体的自由能-组成曲线及相平衡图。Tl温度时,液相是稳定的,T2温度时,液相与a固溶体平衡。T3时,两个不同组成的液相分别和a、b固溶体平衡。T4时,组成为k的液相同时和a、b固溶体平衡。T5、T6时,两个固溶体是平衡的,而液相的自由能高,不稳定,固溶体才是稳定相。图中由公切线的切点可以求得相应各平衡相组成。
上述关于固溶体生成的热力学分析在讨论时作了简化。当然,在无机材料中问题要复杂得多,例如,影响具体材料结合能的因素可能很多。然而,它们并不影响热力学过程的基本规律。因此,上述讨论对理解固溶体的形成及固溶体的影响因素等仍有很大帮助。
(本节完)
|

