| 5.6 非化学计量化合物缺陷(2)
2. 阳离子空位型(Fe1-xO、Cu2-xO)
当环境氧分压升高时,氧就有可能溶入晶体,进入晶体后存在两种可能性:进入间隙位置或者占据晶格位置。当环境高分压的氧溶入晶体后占据晶格位置时,就生成阳离子空位型非化学计量化合物,如图5-39所示。氧溶入后捕获电子,为了保持电中性,迫使正离子给出电子而变为高价,产生正离子空位和电子空穴。与上面讨论情况相类似,电子空穴不固定属于某个正离子,当它与某个正离子联系,就使它变为高价。电子空穴在电场作用下是运动的,因而形成电子空穴导电,材料呈p型半导性。
Fe1-xO就是阳离子缺位型非化学计量化合物,可看作Fe2O3在FeO中的固溶体,或者理解为部分Fe2+变为Fe3+后由二者形成的固溶体,其固溶式为Fe1-xFe(2/3)x)O,缺陷反应式如下:
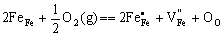 (5-78) (5-78)
或简化成
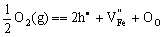 (5-79) (5-79)
Fe离子空位带负电,为保持电中性,两个电子空穴被吸收到 周围,形成V-色心。
仿上根据质量作用定律,可以推导得到平衡时:
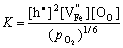 (5-80) (5-80)
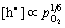 (5-81) (5-81)
即随着氧分压增加,电子空穴浓度增大,电导率也相应提高。
3. 阴离子间隙型(UO2+x)
当环境氧分压升高,而溶入的氧进入间隙位置时,就生成阴离子间隙型非化学计量化合物,如图5-40所示。 目前只发现UO2晶体中有这种缺陷产生,可视作U2O5在UO2中的固溶体。由于阴离子进入间隙位置,为保持电中性,迫使部分正离子转变为高价,同时引入电子空穴。电子空穴也不局限于特定的正离子,它在电场作用下会运动,形成p型半导体。 目前只发现UO2晶体中有这种缺陷产生,可视作U2O5在UO2中的固溶体。由于阴离子进入间隙位置,为保持电中性,迫使部分正离子转变为高价,同时引入电子空穴。电子空穴也不局限于特定的正离子,它在电场作用下会运动,形成p型半导体。
这类非化学计量化合物的缺陷反应可表示为:
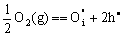 (5-82) (5-82)
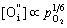 (5-83) (5-83)
随着氧分压升高,间隙氧浓度增大,亦即电子空穴浓度增大,材料电导性提高。
|

