| 5.6 非化学计量化合物缺陷(1)
1. 阴离子缺位型(TiO2-x、ZrO2-x)
当环境中氧气氛压力减小或者在还原性气氛中,晶体中氧就会逸出而在晶格中产生氧空位。O2分子逸出要释放电子,这就要求正离子接纳电子而发生变价,使正离子价数降低。所以,能够生成这类缺陷的化合物的正离子多为多价态离子。TiO2晶体在低氧分压环境中就生成阴离子缺位型非化学计量化合物,氧逸出而在晶体中留下空位,使金属离子与化学式相比显得过剩。从化学观点看,缺氧的TiO2可以看作是四价钛和三价钛氧化物的固溶体,非化学计量缺陷反应如下:
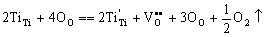 (5-72) (5-72)
可简写成
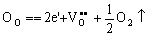 (5-73) (5-73)
式中,e′ = Ti′Ti
在氧逸出的地方留下一个空位,同时放出2个电子,这2个电子被束缚在氧空位周围,以保持电中性,如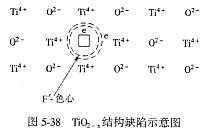 图5-38所示。电子并不永久与某个Ti4+结合使其真正降为+3价,即电子并不固定属于某个Ti离子,而是在电场作用下在空位周围运动,容易从一个Ti4+位置迁移到另一个Ti4+位置。在某个时刻,如果电子与附近某个Ti4+离子相联系,此时这个Ti4+临时获得一个电子而变成Ti3+,在另一个时刻,电子与另一个Ti4+离子相联系。由于电子在电场作用下发生迁移而形成电子电导,所以具有这种缺陷的材料是一种n型半导体。 图5-38所示。电子并不永久与某个Ti4+结合使其真正降为+3价,即电子并不固定属于某个Ti离子,而是在电场作用下在空位周围运动,容易从一个Ti4+位置迁移到另一个Ti4+位置。在某个时刻,如果电子与附近某个Ti4+离子相联系,此时这个Ti4+临时获得一个电子而变成Ti3+,在另一个时刻,电子与另一个Ti4+离子相联系。由于电子在电场作用下发生迁移而形成电子电导,所以具有这种缺陷的材料是一种n型半导体。
凡是电子陷落在阴离子缺位中而形成的缺陷称为F-色心,它是由负离子空位和陷落在此位置上的电子所组成。由于陷落电子能吸收一定波长的光发生跃迁而使晶体着色,故而得名色心。
下面推导平衡时氧空位浓度与氧分压的关系。
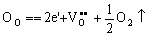 (5-74) (5-74)
根据质量作用定律,平衡时有:
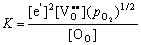 (5-75) (5-75)
式中,K为缺陷反应平衡常数,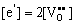 ,同时空位浓度相对较小,可近似认为[OO]=1,由此得到: ,同时空位浓度相对较小,可近似认为[OO]=1,由此得到:
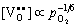 (5-76) (5-76)
由于电导率σ与[e′]成正比,所以
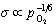 (5-77) (5-77)
上面公式说明氧空位的浓度与氧分压的1/6次方成反比。如果氧分压越低,则氧空位浓度越高,也意味着电子浓度越高,材料的电导性越高。所以TiO2材料如金红石质电容器在烧结时对氧分压是十分敏感的,如在强氧化气氛中烧结,将得到金黄色电介质材料;如果烧结中氧分压不足,将获得灰黑色的n型半导体。PSZ型ZrO2陶瓷在还原气氛中烧结因生成 而变成浅灰色,在氧化气氛中烧结为白色。
|

